В настоящее время актуальность изучения проблемы ожирения в детском возрасте не вызывает сомнения. За последние тридцать лет количество детей с избыточной массой тела увеличилось более чем на 100%. По данным A. A. Hedley et al. (2004), в США 22,6% пациентов в возрасте 2-5 лет и 31% в возрасте 6-19 лет имеют риск развития избыточной массы тела. Индекс массы тела (ИМТ), превышающий 95 перцентиль, отмечается у 10,3% 2-5-летних и 16% 6-19-летних.
Избыточная масса тела и ожирение связаны с серьезными медицинскими, социально-экономическими и психологическими проблемами. Ожирение является существенным фактором риска развития сахарного диабета 2 типа (СД 2 типа) в детской популяции. Параллельно увеличению распространенности избыточной массы тела наблюдается рост заболеваемости СД 2 типа. Число больных этой эндокринопатией в разных странах составляет 8-45% от общего количества детей с диабетом. В нашей республике за последний год распространенность СД 2 типа среди детского населения увеличилась более чем на 60%. Предполагается, что фактическое число больных СД 2 типа вследствие несвоевременной диагностики и длительного бессимптомного начала заболевания в 2-3 раза превышает регистрируемое. Проведенное O. Pinhas-Hamiel et al. (1996) ретроспективное изучение (1982-1994 гг.) распространенности сахарного диабета 2 типа среди детей и молодых взрослых (до 19 лет включительно) показало ее десятикратное повышение. В этом исследовании все вновь диагностированные больные с нарушением углеводного обмена имели ожирение (среднее значение индекса массы тела 37,7 ± 9,6 кг/м2) и отягощенный семейный анамнез по СД 2 типа. Подобные результаты получены и в более поздней работе A. Fagot-Campagna (2000).
Таким образом, данные эпидемиологических исследований указывают на возрастающую распространенность ожирения и сахарного диабета 2 типа в детской популяции и позволяют охарактеризовать эти заболевания как хронические неинфекционные эпидемии, распространяющиеся с постоянно увеличивающейся скоростью. Неблагоприятное влияние ожирения на углеводный обмен и его частое сочетание с СД 2 типа предопределили появление в литературе термина Diabesity («ДиаОжирение»).
Значимость манифестации сахарного диабета 2 типа в детском возрасте заключается в раннем формировании поздних осложнений, таких как нефропатия, ретинопатия, нейропатия, прогрессировании сердечно-сосудистой патологии и дислипидемии, приводящих к увеличению заболеваемости и смертности у взрослых. Патогенез сахарного диабета 2 типа у детей характеризуется сочетанием дисфункции β-клеток и сниженной чувствительности периферических тканей к инсулину (табл.1). Дисфункция β-клеток характеризуется изменением синтеза или превращения инсулина, нарушением его секреции. В развитии заболевания у детей ведущая роль принадлежит инсулинорезистентности (ИР).
Таблица 1.
Факторы, способствующие нарушению гомеостаза глюкозы при развитии и прогрессировании сахарного диабета 2 типа (по W. Kiess et al. (2003))
| Чувствительность к инсулину |
| Нарушение инсулиновой чувствительности. Инсулинорезистентность. |
| β-клеточная дисфункция |
| Секреция инсулина (гипо-, гиперинсулинемия). Дефицит инсулина. |
| Другие факторы |
| Клиренс инсулина. (Контр)регуляторный ответ (резистин?, глюкагон?, лептин). |
Инсулинорезистентность является генетически детерминированным фактором приложения внешних воздействий на организм ребенка (избыточного высококалорийного питания, низкой физической нагрузки, индекса массы тела более 90 перцентили для данного пола и возраста, пубертата, принадлежности к определенной расе/этнической группе и др.) (рис. 1). Сниженную чувствительность периферических тканей к инсулину рассматривают как важный механизм в формировании спектра метаболических расстройств при манифестации СД 2 типа у детей (см. табл. 1). В условиях инсулинорезистентности β-клетки поджелудочной железы компенсаторно повышают секрецию инсулина для поддержания эугликемии. Гиперинсулинемия приравнивается к косвенным признакам инсулинорезистентности и рассматривается в качестве предвестника развития СД 2 типа.
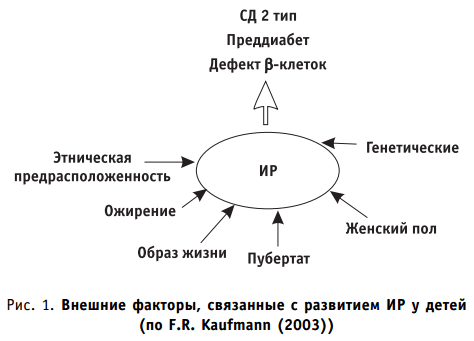
Выделяют несколько уровней генетических поломок, результатом которых является формирование инсулинорезистентности. Пререцепторный уровень нарушений характеризуется наличием мутаций, в результате которых образуются аномальные молекулы инсулина; рецепторный — мутаций, вызывающих уменьшение инсулиновых рецепторов (IR) или приводящих к их аномальным формам или нарушению инсулинрецепторного сигнала (IR/IRS-1). Пострецепторные поломки обусловлены генетическими дефектами, ответственными за передачу сигнала после соединения инсулина со своим рецептором. Прежде всего нарушается транслокация переносчика глюкозы ГЛЮТ-4 вследствие дефектов на уровне IRS-1 и/или PI 3K (фосфатидилинозитол-3-киназы). При СД 2 типа выявлена нарушенная экспрессия и других генов, обеспечивающих метаболизм глюкозы и липидов: гена глюкозо-6-фосфатдегидрогеназы, глюкокиназы, липопротеинлипазы, синтазы жирных кислот. При избыточной массе тела инсулинорезистентность имеет место в 100%, СД 2 типа — 80%.
При прогрессировании сахарного диабета 2 типа наиболее клинически значимым является снижение инсулиновой чувствительности мышечной, жировой и печеночной тканей. Нарушается поступление и утилизации глюкозы в миоцитах. Инсулинорезистентность ткани печени проявляется понижением синтеза гликогена и активацией процессов гликогенолиза и глюконеогенеза. Инсулинорезистентность жировой ткани выражается в уменьшении чувствительности к антилиполитическому действию инсулина, ведущему к накоплению глицерина и свободных жирных кислот. Активация липолиза в висцеральных адипоцитах приводит к высвобождению большого количества свободных жирных кислот (СЖК), оказывающих липотоксический эффект. Свободные жирные кислоты являются основой для формирования атерогенной фракции холестерина. Гиперлипидемия, особенно постпрандиальная, сопровождается отложением липидов в мышцах, печени и β-клетках поджелудочной железы, что нарушает активность ферментов, принимающих участие в метаболизме глюкозы, и способствует нарастанию инсулинорезистентности. В процессе развития сахарного диабета 2 типа, при начинающемся истощении секреторной функции β-клеток и относительном снижении гиперинсулинемии, вначале страдает функция захвата глюкозы мышечной тканью, потом — гликогенсинтетическая способность печени и в последнюю очередь — снижение липолитической функции жировой ткани.
По мнению ряда авторов, предрасположенность к развитию инсулинорезистентности и сахарного диабета 2 типа у детей развивается внутриутробно. Постнатальное формирование гиперинсулинемии и инсулинорезистентности является последствием и задержки внутриутробного развития, и макросомии плода. Макросомия является результатом воздействия генетических механизмов, которые регулируют секрецию фетального инсулина и определяют чувствительность к нему фетальных тканей. Макросомия — маркер эмбриональной гиперинсулинемии.
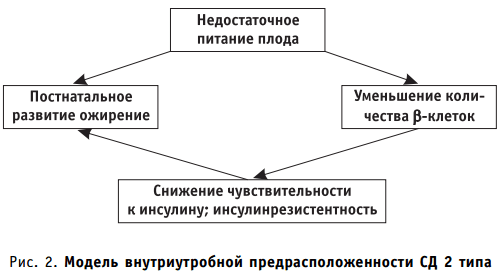
В настоящее время в литературе активно обсуждается гипотеза «бережливого генотипа» J. V. NeeL (1962). Механизм формирования инсулинорезистентности рассматривается как компенсаторно-приспособительный ответ организма плода на алиментарный внутриутробный дефицит нутриентов. Сохранение модели эмбриональной инсулинорезистентности в генетической памяти ребенка вызывает постнатальное накопление энергии при избыточном поступлении калорий, ведет к раннему ожирению, нарушению углеводного и жирового обменов. При задержке внутриутробного развития отмечается усиление апоптоза β-клеток поджелудочной железы со снижением их массы (рис. 2). Уменьшение массы β-клеток при наличии генетической предрасположенности и влиянии внешнесредовых диабетогенных факторов вызывает манифестацию СД 2 типа в детском возрасте. Таким образом, прогностически неблагоприятный признак для развития сахарного диабета 2 типа — рождение маловесных детей к сроку гестации.
Одним из значимых факторов, участвующих в генезе инсулинорезистентности при СД 2 типа у детей, является процесс полового созревания. Для пубертата характерны физиологическая гиперинсулинемия, относительное снижение периферической чувствительности к инсулину. Развитие инсулинорезистентности сопровождается активацией ростовой оси. Отмечается увеличение уровней инсулиноподобных факторов роста и соматотропного гормона, низкие концентрации связывающих их белков.
В настоящее время считается, что ключевым моментом в формировании сахарного диабета 2 типа является характер распределения жировой ткани в организме. Повышение массы абдоминальновисцерального жира ассоциируется с метаболическими нарушениями: гиперинсулинемией, инсулинорезистентностью, дислипидемией. Понимание, что жировая ткань — не только энергетическое депо, а важный эндокринный орган, помогло в понимании патофизиологии СД 2 типа у детей. Избыточная масса тела в детском возрасте способствует усилению физиологической гиперинсулинемии и относительному снижению чувствительности периферических тканей к инсулину. При обследовании детей с ожирением гиперинсулинемия выявлена в 67, инсулинорезистентность — в 79% случаев. Тощаковые показатели инсулина и инсулинорезистентности возрастали пропорционально степени ожирения. По данным литературных источников, ожирение в детском возрасте, особенно по абдоминальному типу, — фактор риска раннего развития сахарного диабета 2 типа. При ожирении в формировании инсулинорезистентности существенное значение придается адипоцитокинам, секретируемым висцеральной жировой тканью.
С открытием лептина — нейрогормонального медиатора, продукта гена ожирения, продуцируемого адипоцитами, — изменился взгляд на проблему ожирения. Основная мишень действия гормона — гипоталамус, где он связывается с ob-рецепторами, активируя сигналы, тормозящие прием пищи, и повышает расход энергии. Отрицательный энергетический баланс организма, вызванный ограничением потребления пищи или голоданием, ведет к уменьшению концентрации лептина, тогда как положительный, связанный с перееданием, увеличивает его уровень. Рецепторы лептина найдены в периферических тканях (легких, почках, печени, поджелудочной железе, надпочечниках, яичниках, гемопоэтических клетках, скелетных мышцах). Это позволяет трактовать роль лептина шире, чем только циркулирующий фактор насыщения.
Уровень лептина пропорционален количеству жировой массы ребенка. Выявлены возрастные и половые особенности продукции гормона у детей. В препубертате наблюдаются низкие показатели сывороточного лептина вне зависимости от пола. В раннем пубертатном периоде его уровень увеличивается. После этого концентрация лептина у мальчиков снижается (установлена отрицательная корреляция с ростом размеров яичек), достигая минимума на 5-й стадии развития гениталий. У девочек уровень этого гормона остается постоянным до середины пубертата и достигает максимума на 5-й стадии по Таннеру.
Дефицит лептина, проявляющийся морбидным ожирением, достаточно редок в педиатрической практике и обусловлен мутацией ob-рецептора. У большинства детей с избыточной массой тела отмечается повышенная секреция лептина, постепенно приводящая к развитию лептинорезистентности. Лептинорезистентность может быть результатом сигнального дефекта в лептин-чувствительных нейронах гипоталамуса или нарушения транспорта гормона через гематоэнцефалический барьер.
Показано, что лептин улучшает чувствительность к инсулину. Это действие опосредуется прямым и непрямым влиянием на активность АМФ-киназы и увеличением окисления жирных кислот в мышечной ткани, что приводит к снижению содержания интрамиоцеллюларных липидов. При ожирении в условиях лептинорезистентности не происходит реализации этих эффектов. Это способствует отложению триглицеридов между мышечными волокнами, в миоцитах, печени, поджелудочной железе. Таким образом, при избыточном развитии жировой ткани лептинорезистентность является ведущим фактором в развитии инсулинорезистентности и нарушении функции β-клеток.
При ожирении наблюдается повышение выделения висцеральными адипоцитами фактора некроза опухолей-α (ФНО-α). Этот цитокин обладает ауто— и паракринным действием и способствует развитию инсулинорезистентности преимущественно в жировой ткани. Увеличение синтеза ФНО-α снижает активность тирозинкиназы инсулинового рецептора, приводит к усилению фосфорилирования серина субстрата инсулинового рецептора и уменьшению экспрессии транспортера глюкозы ГЛЮТ-4 в мышечной и жировой тканях. ФНО-α рассматривают в качестве медиатора инсулинорезистентности и регулятора энергетического обмена в организме. Этот адипоцитокин регулирует функциональные взаимосвязи между жировой тканью и инсулин-чувствительными органами и тканями (печень, мышцы). ФНО-α способствует развитию инсулинорезистентности и непрямым путем — через стимуляцию липолиза в жировой ткани, продукцию свободных жирных кислот.
Ингибитор активатора плазминогена-1 (ПАИ-1) участвует в процессах свертывания крови. Степень риска сахарного диабета 2 типа зависит от уровней плазминогена-1. Секреция этого адипоцитокина в жировой ткани зависит от уровней ФНО-α. Пропорционально нарастанию массы жировой ткани в крови повышается концентрация интерлейкина-6, который является ауто- и паракринным регулятором функции адипоцитов. Этот адипоцитокин оказывает прямое действие на формирование инсулинорезистентности на уровне гепатоцитов путем подавления чувствительности инсулиновых рецепторов.
В организме адипонектин, в отличие от лептина, ФНО-α, интерлейкина-6 и плазминогена-1, выполняет защитную функцию, улучшая воздействие эффектов инсулина на эндотелиальную функцию. Плазменные концентрации адипонектина обратно коррелируют с выраженностью ожирения. Уровень адипонектина повышается при голодании и снижении массы тела на фоне низкокалорийной диеты у больных с ожирением. Низкий уровень этого адипоцитокина предшествует развитию инсулинорезистентности. В эксперименте показано, что адипонектин уменьшает инсулинорезистентность, стимулируя фосфорилирование тирозина — рецептора инсулина. Дополнительный механизм влияния адипонектина на инсулинорезистентность заключается в снижении поступления жирных кислот в печень и стимуляции их окисления путем активации протеинкиназы. Это приводит к уменьшению продукции глюкозы печенью, а также синтезу липопротеидов очень низкой плотности. Таким образом, жировая ткань представляет собой не пассивный накопитель жиров, а метаболически активную ткань, секретирующую большое количество биологически активных веществ, участвующих в генезе сахарного диабета 2 типа у детей.
Ожирение — важнейший, но не единственный фактор риска сахарного диабета 2 типа. Влияние собственно ожирения на развитие диабета у детей в значительной степени могут усилить другие сопутствующие факторы (малоподвижный образ жизни, определенный характер питания ребенка с употреблением высококалорийных продуктов, содержащих много легкоусвояемых углеводов, небольшое количество клетчатки, прием алкоголя). Для успешной профилактики сахарного диабета 2 типа в детской популяции необходимо не только активное лечение уже развившегося ожирения, но и борьба с избыточной массой тела и гиподинамией как в группах высокого риска, так и в обществе в целом.
Солнцева А. В. Белорусский государственный медицинский университет, г. Минск.
Опубликовано: «Медицинская панорама» № 5, апрель 2008.
