Антибактериальная активность in vitro определяли путем использования минимальных подавляющих концентраций (МПК) против бактерий клинических штаммов и коллекций исходных культур. Следует обратить внимание, что сложно интерпретировать показатели МПК при отсутствии известных желудочно-кишечных концентраций. Однако вероятно, что концентрация препарата в желаемом очаге воздействия, то есть ЖКТ, будет значительно превышать указанные МПК. Например, содержание препарата в фекалиях после перорального приема антибиотика варьируется от 4000 до 8000 мкг/г стула, что в 160-250 раз больше МПК-90 для различных бактериальных энтеропатогенов.
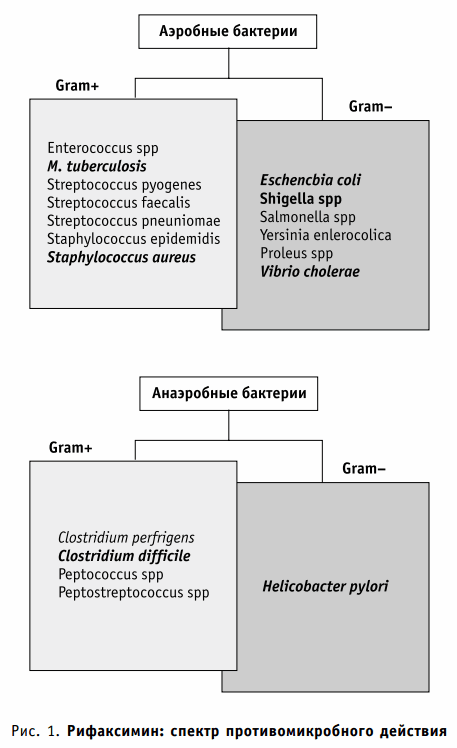
Несколько исследований in vitro, обобщенных в последних обзорах, продемонстрировали, что рифаксимин, подобно рифампицину, оказывает подавляющее действие в отношении грамположительных и грамотрицательных аэробных и анаэробных бактерий (рис. 1). Действие против широкого ряда энтеропатогенов подчеркивает клиническую эффективность этого антибиотика при желудочно-кишечных инфекциях, а также других функциональных и органических желудочно-кишечных заболеваниях, в патогенезе которых важную роль играет кишечная флора. Когда в ходе клинических испытаний проанализировали in vitro 427 энтеропатогенов от больных с инфекционной диареей, обнаружилась активность рифаксимина против всех культур.
В недавнем многоцентровом исследовании сообщалось о благоприятном действии этого антибиотика на явления протозойной диареи у пациентов с диареей путешественника (ДП). Вне сомнения, клиническое улучшение у больных с исходным наличием в фекалиях Cryptosporidium-инфекции на фоне лечения рифаксимином значительно превысило улучшение у пациентов, получавших плацебо.
Как и другие представители семейства рифамицина, рифаксимин является специфическим ингибитором РНК-синтетазы путем подавления β-подгруппы ДНК-зависимой РНК-полимеразы. Самые последние исследования с применением рентгеновской кристаллографии действительно продемонстрировали, что данные антибиотики действуют путем изъятия каталитических ионов магния из РНК-полимеразы бактерии и подавление фермента отличается в зависимости от структурных различий рифамицинов.
Развитие устойчивости к рифаксимину и рифампицину может быть похожим, что в первую очередь обусловлено пошаговой хромосомальной перестройкой в мишени препарата — ДНК-зависимой РНК-полимеразе. Это отличается от плазимид-опосредованной устойчивости, часто приобретаемой бактерией к таким аминогликозидам, как неомицин или бацитрацин. Распространение устойчивости благодаря хромосомальному механизму является, однако, более редким, чем благодаря плазимид-опосредованному переносу.
Развитие устойчивости к рифаксимину детально изучено на нескольких аэробных (грамотрицательных и грамположительных) и анаэробных штаммах. Как и предполагалось, спонтанный (самостоятельный) отбор устойчивости для анаэробов оказался редким; на самом деле только у нескольких видов этих анаэробов отмечено спонтанное возникновение устойчивых мутировавших микроорганизмов. Избирательно устойчивые к рифаксимину аэробные грамположительные кокки легче мутируют в аэробных, чем в анаэробных условиях. По сравнению с грамположительными микроорганизмами грамотрицательные микробы с лекарственной устойчивостью определялись редко.
Спонтанно устойчивые мутанты легче отбирались после преинкубации исследуемых бактерий с субподавляющими концентрациями рифаксимина, чем после экспозиции микроорганизмов при высоких дозах. С учетом того, что рифаксимин имеет плохую всасываемость (см. ниже), он больше доступен в просвете пищеварительного тракта при больших концентрациях препарата, чем при субподавляющих концентрациямих. Более того, поскольку анаэробная среда затрудняет отбор рифаксимин-устойчивых энтеробактерий, предположили, что во время терапии данным препаратом отбор устойчивых мутантов в ЖКТ (преимущественно анаэробная среда) очень мал.
В заключение необходимо сказать, что благодаря высокой биодоступности препарата в условиях недостатка кислорода возникновение in vivo устойчивости бактерий к рифаксимину должно быть редким феноменом. Стабильная терапевтическая эффективность данного антибиотика при лечении различных желудочно-кишечных инфекций четко наводит на мысль, что дело обстоит именно так.
Создание высоких концентраций в просвете ЖКТ при повторных пероральных приемах антибиотика может оказать сильное воздействие на кишечную флору. Предполагается значительное снижение количества бактерий в фекалиях на фоне перорального приема рифаксимина. Но это действие кратковременное, поскольку популяция бактерий восстанавливается в течение 1-2 недель после окончания лечения. Образование колоний грибов наблюдалось очень редко, что наиболее важно. На самом деле, Candida albicans, которая также вовлечена в патогенез антибиотик-ассоциированной диареи, выделили только из 2 среди 10 проб фекалий пациентов, получавших 1200 мг рифаксимина в сутки и не обнаружили у здоровых добровольцев, получавших 800 мг в сутки.
Противомикробная устойчивость к рифамицинам быстро развивается и in vitro, и in vivo. Как следствие, все три представителя семейства (то есть рифампицин, рифабутин и рифапентин) используются в клинической практике в качестве компонентов комбинированной терапии. Поскольку рифаксимин имеет родственную структуру, то и он может обладать таким свойством. И действительно, частота развития устойчивости, зарегистрированная по штаммам Enterobacteriaceae, Enterococcus, Bacteroides, Clostridium и анаэробных кокков в фекалиях, колеблется в пределах 30-90% после короткого курса (5 дней) антибиотика (800 мг в сутки).
Похожие результаты наблюдались по окончании лечения рифаксимином у 10 пациентов с печеночной энцефалопатией, которые получали 1200 мг в сутки курсом 5 дней. Несмотря на это, после завершения терапии наблюдалось быстрое исчезновение устойчивости бактерий. Однако кинетика исчезновения устойчивости различалась. Аэробные виды быстрее возвращались к исходной чувствительности, тогда как анаэробные бактерии, особенно грамотрицательные палочки, восстанавливали чувствительность к рифаксимину медленнее. Во всяком случае, через три месяца после окончания лечения больше не обнаруживалось устойчивых штаммов в испражнениях. Эти результаты подтверждают необходимость цикличного применения рифаксимина, что и было принято исследователями в ходе лечения печеночной энцефалопатии и дивертикулеза толстого кишечника.
___________________________
Вы читаете:
«Альфа Нормикс» (рифаксимин): экспериментальная и клиническая фармакология селективного кишечного антибиотика (Скарпиньято Кармело, Пелозини Ива. Школа медицины и стоматологии, Университет Пармы; г. Парма, Италия. «Медицинская панорама» № 2, февраль 2009)
- Невсасывающиеся антибиотики в лечении кишечных инфекций.
- Противомикробная активность рифаксимина.
- Фармакокинетика в организме человека и животных.
- Взаимодействия с другими препаратами.
- Общая фармакология рифаксимина.
- Клиническое применение и терапевтические возможности.
- Безопасность и переносимость.
- Выводы и заключение о рифаксимине.
