Несмотря на большое количество лекарственных средств, постоянно пополняющих арсенал кардиологов, символом успешной терапии многих сердечно-сосудистых заболеваний стали препараты из группы ингибиторов ангиотензинпревращающего фермента (ингибиторов АПФ). Эта группа утвердилась в качестве эффективного средства лечения артериальной гипертензии (АГ), хронической сердечной недостаточности (ХСН), а также профилактики дисфункции левого желудочка после инфаркта миокарда и диабетической нефропатии. В многоцентровых исследованиях было подтверждено снижение частоты инфаркта миокарда, тяжелой ХСН, эпизодов нестабильной стенокардии и повышение выживаемости на фоне приема ингибиторов АПФ.
Создание ингибиторов АПФ стало возможным благодаря выявлению участия ренин-ангиотензиновой системы в развитии основных сердечно-сосудистых заболеваний. Согласно нейрогормональной теории гиперактивация локальных (миокардиальных) симпатико-адреналовой и ренин-ангиотензин-альдостероновой систем (РААС) происходит после воздействия первичного повреждающего фактора, к которому относятся перегрузка давлением при АГ или объемом при неполном смыкании клапанов сердца, а также некроз участка сердечной мышцы при инфаркте миокарда. Компенсаторные реакции, стимулирующие гипертрофию сердечной мышцы и дилатацию полости сердца при прогрессировании процесса, вызывают комплекс структурных и функциональных изменений, т.е. ремоделирование. Вследствие этого происходит нарушение диастолической, а затем систолической функции миокарда.
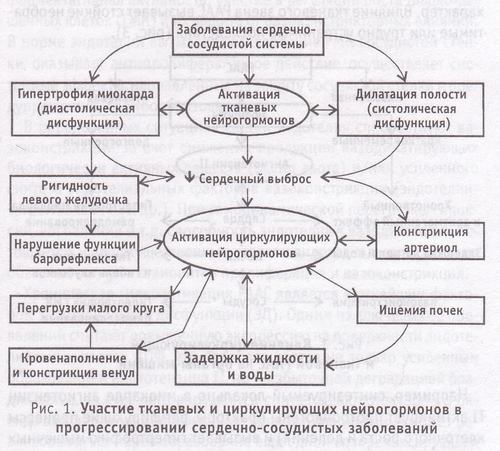
Снижение сердечного выброса является фактором, запускающим системные изменения в организме, среди которых ведущая роль принадлежит циркулирующим нейрогормонам (рис. 1).
До недавнего времени РААС рассматривалась как циркулирующая нейроэндокринная система. В результате исследований в области молекулярной и клеточной биологии стало известно, что основные компоненты РААС могут образовываться в тканях, где и происходит их взаимодействие. Тканевые или локальные компоненты РААС предположительно выполняют пара-, ауто- и/или интракринные функции. К наиболее изученным составляющим циркулирующей РААС относят ренин, ангиотензиноген, ангиотензин I, ангиотензин-I превращающий фермент (АПФ), ангиотензин II и специфические рецепторы для ангиотензиновых пептидов.
Ангиотензин II считается главным эффекторным пептидом РААС и, циркулируя в крови, оказывает действие в различных органах и тканях в основном через рецепторы двух типов - AT1 и АТ2 (рис. 2).
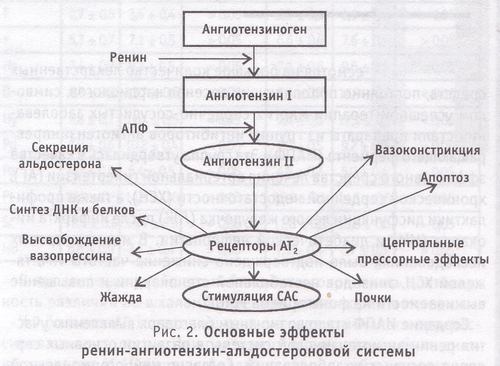
Основные эффекты ангиотензина II включают
- вазоконстрикцию вен и артерий;
- активацию в коре надпочечников биосинтеза и секреции альдостерона;
- регулирование баланса жидкости путем влияния на реабсорбцию натрия в дистальных отделах почечных канальцев и непосредственно на тонус клубочковых артериол;
- увеличение циркулирующего объема крови.
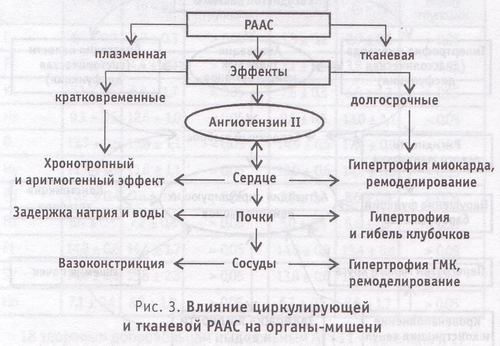
Согласно теории двухкомпонентности РААС, предусматривающей выделение циркулирующего и тканевого звена, определяются их функциональные различия. Циркулирующее звено РААС как система «быстрого реагирования» обеспечивает кратковременный контроль состояния сердечно-сосудистого и почечного гомеостаза. Тканевая РААС представляет систему длительного регулирования, обеспечивающую тоническое медленное действие на структуру и функции органов и тканей. Таким образом, эффекты циркулирующей РААС носят, в основном, приспособительный кратковременный характер. Влияние тканевого звена РААС вызывает стойкие необратимые или трудно устранимые последствия (рис. 3).
Например, синтезируемый локально в миокарде ангиотензин II активирует протоонкогены (факторы, регулирующие процессы клеточного роста и деления) и вызывает гипертрофию мышечных волокон и нарушение архитектоники миокарда. К тому же ангиотензин II стимулирует локальный синтез норадреналина. Соответственно происходят изменения в гладкой мускулатуре периферических сосудов с ее последующей гипертрофией. В почках чрезмерная активация локальной РААС способствует развитию гипертензии клубочков с их последующей гибелью. В мозге избыточное действие ангиотензина II на рецепторы первого типа проявляется стимуляцией пролиферации клеток и вызывает ускорение атеросклеротического поражения сосудов, что ведет к инсульту.
Существенное влияние помимо ангиотензина-I АПФ оказывает на функциональную активность калликреин-кининовой системы. Эффекторные пептиды калликреин-кининовой системы обладают вазоконстрикторными и натрий-уретическими свойствами и воздействуют на отдаленные органы-мишени. Основными компонентами калликреин-кининовой системы являются калликреины, кининогены, кинин-превращающий фермент, брадикинин и специфические рецепторы для брадикинина на клеточных мембранах. Два фермента кининаза I и кининаза II (АПФ) - расщепляют брадикинин и другие кинины до неактивных пептидов. Биологическое действие брадикинина и остальных кининов проявляется при непосредственном влиянии на ткани, они стимулируют или тормозят высвобождение простагландинов Е2 и J2 оксида азота, норадреналина, гистамина, ацетилхолина, субстанции Р и т.д. Чрезвычайно важная роль отводится брадикинину в блокировании гипертрофии кардиомиоцитов, регрессе кардиофиброза, повышении натрий- и диуреза.
Таким образом, блокада АПФ крайне целесообразна для устранения нейрогормонального дисбаланса: с одной стороны, замедляется образование ангиотензина II, с другой - деградация брадикинина.
В основе фармакологического действия ингибиторов АПФ лежит их способность тормозить активность АПФ и тем самым оказывать существенное влияние на функционирование РААС и калликреин-кининовой системы. Таким образом, препараты группы ингибиторов АПФ подавляют образование ангиотензина II и ослабляют основные эффекты стимуляции РААС, которые опосредуются этими ангиотензиновыми пептидами. Снижая активность кининазы II, ингибиторы АПФ способствуют накоплению в тканях и крови брадикинина и других кининов, т.е. потенцируют действие калликреин-кининовой системы.
Прямо или косвенно воздействуя на гиперфункцию РААС и калликреин-кининовой системы, ингибиторы АПФ влияют на активность симпатико-адреналовой системы, тонус блуждающего нерва, секрецию альдостерона, аргинин-вазопрессина и других биологически активных веществ. В результате уменьшается вазоконстрикторное, антинатрийуретическое влияние, усиливаются вазодилатация, натрийурез, активируется калликреин-кининовая система, простагландины Е2 и J2, оксид азота.
Основные свойства ингибиторов АПФ, используемые при лечении сердечно-сосудистых заболеваний, систематизированы в табл. 1.
Таблица 1.
Основные эффекты ИАПФ при сердечно-сосудистых заболеваниях
| Кардиопротективный | Восстановление баланса O2 между потребностью и обеспечением миокарда, уменьшение пред- и постнагрузки левого желудочка, его объема и массы, замедление (реверсия) ремоделирования, снижение симпатической стимуляции, антиаритмическое действие |
| Вазопротекторный | Антиатерогенное, антипролиферативное и антимиграционное влияние на гладкомышечные клетки, нейтрофилы, моноциты, профилактика повреждения атеросклеротической бляшки, улучшение и/или восстановление функции эндотелия, антитромбоцитарный эффект, усиление эндогенного фибринолиза, антигипертензивное действие, улучшение податливости артерий и их тонуса |
| Нефропротекторный | Снижение внутриклубочковой гипертензии, увеличение скорости клубочковой фильтрации, повышение натрийуреза и уменьшение калийуреза, снижение протеинурии, рост диуреза |
| Метаболический | Усиление распада ЛПНП и подавление синтеза триглицеридов, увеличение продукции ЛПВП, повышение чувствительности рецепторов к инсулину и рост потребления глюкозы |
=================
Вы читаете тему:
Ингибиторы ангиотензинпревращающего фермента при лечении сердечно-сосудистых заболеваний
1. Механизм действия и эффекты ингибиторов АПФ.
2. История создания и классификация ингибиторов АПФ.
3. Влияние ингибиторов АПФ на дисфункцию эндотелия.
4. Ингибиторы АПФ и артериальная гипертензия.
5. Ингибиторы АПФ и инфаркт миокарда.
6. Ингибиторы АПФ и хроническая сердечная недостаточность.
Бова А. А., Трисветова Е. Л. БГМУ.
Опубликовано: "Медицинская панорама" № 8, октябрь 2003.