Кожа человека является органом, выполняющим множество функций, одной из которых является защита организма от микроорганизмов, вирусов и бактерий. Защитная функция кожи человека реализуется с помощью нескольких механизмов, важнейшим из которых является иммунная система.
Иммунная система кожи состоит из двух систем: врожденной (естественной) и адаптивной (приобретенной). Врожденная система иммунитета характеризуется отсутствием иммунологической памяти. В результате действия компонентов этой системы происходит повреждение тканей вследствие воспалительной реакции. Механизмы этой системы более просты, чем приобретенной, однако их нарушения могут привести к серьезным последствиям. Адаптивный иммунитет основан на способности Т- и В-лимфоцитов избирательно адаптироваться для каждого конкретного антигена с образованием клеток памяти. Обе системы иммунитета находятся в тесной взаимосвязи, и нарушения одной из систем вызывают изменения в другой.
К врожденной системе иммунитета кожи относят комплемент, нейтрофилы, эозинофилы, натуральные киллеры (NK), тучные клетки, цитокины и открытые сравнительно недавно антимикробные пептиды (АМП).
Комплемент состоит из 20 гликопротеинов плазмы, которые активируются с помощью классического и альтернативного путей. Недавно открыт новый путь активации — посредством связывания карбогидратов микробной стенки с маннозосвязывающими белками. Все три пути приводят к активации С3-компонента и выработке иммуноактивных веществ.
Функции макрофагов, нейтрофилов, эозинофилов, натуральных киллеров, тучных клеток изучены более детально. Основной их задачей является нейтрализация различных антигенов, микроорганизмов и паразитов.
Цитокины — группа низкомолекулярных веществ, которые вырабатываются практически всеми клетками и обеспечивают межклеточное взаимодействие. В механизмах врожденного иммунитета в основном играют роль цитокины воспаления: интерлейкины (IL) — 1, 6, фактор некроза опухоли альфа (ФНО-α), воспалительные хемокины, а также противовирусные интерфероны α и β (IFN-α, -β). В реакциях адаптационного приобретенного иммунитета участвуют цитокины с иммуномодулирующими свойствами — IL-2, IL-4, IL-10, IL-12, IL-13, IL-18, IL-23, IFN-γ.
Врожденная иммунная система обладает механизмом распознавания молекулярных частиц микроорганизмов. Распознавание антигенов в организме происходит с помощью различных рецепторов. Молекулярные механизмы иммунного распознавания микробной клетки в организме человека изучены не полностью. Рецепторы клеток иммунной системы, связывающиеся с микробным агентом, называют Toll-рецепторами (ТР). Их в настоящее время открыто десять. Каждый из Toll-рецепторов ответственен за распознавание различных компонентов клеточной стенки бактерий. Так, например, ТР-2 связывается с липопротеинами и пептидогликанами грамположительных бактерий, ТР-4 распознают липополисахариды грамотрицательных бактерий, ТР-5 — с флагеллином — компонентом жгутиков бактерий, ТР-9 — распознает последовательности ДНК бактерий. Вероятно, Toll-рецепторы способны связываться и с вирусными частицами. Связывание с ТР приводит к активации фактора транскрипции (NFkB) и выработке интерферонов. Дендритные клетки также имеют Toll-рецепторы, после активации которых антигены представляются интактным Т-лимфоцитам, обеспечивая таким образом связь между врожденной и приобретенной системой иммунитета.
В настоящее время известно сравнительно немного о роли антимикробных пептидов в защите кожи, однако дальнейшее их изучение может привести к синтезу новых противомикробных препаратов, устойчивость к которым будет развиваться медленнее, чем к синтезированным антибиотикам. Первый антимикробный пептид — β-дефензин-2 — был выделен из чешуек кожи больных псориазом.
Антимикробные пептиды — факторы врожденной системы иммунитета, защищающие кожу от микробов, грибов и, возможно, вирусов. Выработка этих веществ в организме индуцируется микробными частицами путем связывания с Toll-рецепторами, однако, по всей видимости, это не единственный механизм. Их действие можно сравнить с природными антибиотиками, которые способны убивать бактерии. Исследования на моделях животных показали, что при подавлении генов, ответственных за синтез антимикробных пептидов, у животных значительно возрастает чувствительность к стрептококковым инфекциям.
Известны два семейства антимикробных пептидов — кателицидины и дефензины. Кателицидины — группа антимикробных белков, обладающих N-терминальным сигнальным белком, неизменной кателиновой частью и структурно изменяющимся С-участком. Кателицидины обладают широким спектром антимикробной и иммуномодуляторной активности. У человека и мышей существует только один ген, ответственный за выработку кателицидинов, в то время как у других млекопитающих их несколько.
Антимикробные пептиды, синтезируемые в разных клетках, могут иметь различные функции. Кателицидин LL-37, который синтезируется в клетках эккриновых желез и выделяется с потом, обеспечивает его противомикробные свойства, а молекулы LL-37, вырабатываемые в тучных клетках, способствуют их активации и вовлекают их в иммунный процесс. Наряду с прямой антимикробной способностью этот белок взаимодействует с другими белками, вызывает миграцию нейтрофилов, моноцитов и Т-клеток, стимулирует пролиферацию эндотелия. У новорожденных содержание LL-37 повышено, что компенсирует недостаточность адаптационного иммунитета.
Дефензины характеризуются наличием шести цистеиновых частиц с тремя дисульфидными мостиками. На сегодняшний день открыты 6 α- и 4 β-дефензина. α-дефензины вырабатываются нейтрофилами и клетками желудочно-кишечного тракта. β-дефензины встречаются в коже и дыхательном тракте. Как и каталицидины, дефензины обладают широким спектром противомикробной активности и вместе с тем стимулируют выработку ФНО-α и IL-1 моноцитами. β-дефензин-2 отсутствует в здоровой коже, однако появляется при воспалительных процессах, при которых способствует выбросу гистамина и простагландина из тучных клеток.
Кроме этих двух наиболее изученных групп антимикробных пептидов, показано, что некоторые другие протеины — ингибиторы протеиназы, хемокины и нейропептиды — обладают противомикробными свойствами. Механизмы их противомикробного действия различны и зависят от строения их молекул.
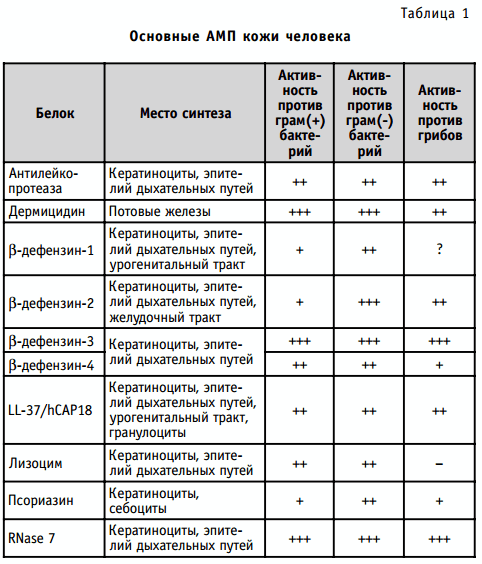
Антимикробные пептиды, играющие роль в обеспечении противомикробной защиты кожи у человека, представлены в табл. 1.
Концентрация антимикробных пептидов в коже различна. У здоровых лиц содержание антимикробных пептидов повышено в тех участках кожи, где более вероятно проникновение инфекции — в частности, в коже подмышечных областей и потовых железах.
Повышенные концентрации этих пептидов препятствуют вторичному инфицированию кожных высыпаний при хронических кожных заболеваниях. Так, например, содержание LL-37 повышено при псориазе, красной волчанке и контактном дерматите. У больных псориазом также повышено содержание β-дефензинов-2 и -3, что препятствует вторичному инфицированию бляшек. При атопическом дерматите происходит обратное: содержание антимикробных пептидов снижено, что приводит к повышенной восприимчивости к различным инфекциям.
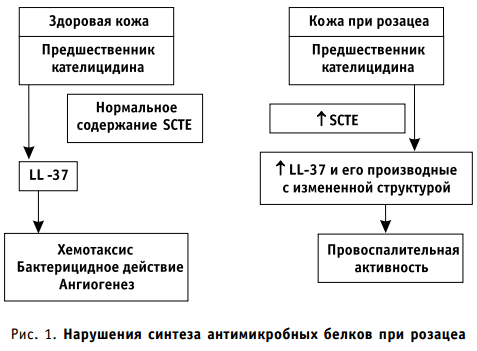
Антимикробные пептиды проливают свет на патогенез розацеа, при котором отмечается значительно большее содержание кателицидинов в коже. У больных розацеа молекулы антимикробных пептидов отличаются от таковых у здоровых лиц, что связано также с повышенным содержанием трипсинового фермента рогового слоя кожи (SCTE). Введение LL-37 совместно с SCTE приводит к развитию розацеаподобного дерматита у мышей. Этот механизм частично объясняет эффективность применения тетрациклинов у больных розацеа, действие которых направлено не на микробный агент, а является иммодуляторным (рис. 1).
Этот механизм позволяет обосновать применение противовоспалительных дозировок тетрациклинов, которые значительно ниже применяемых обычно доз и обладают меньшими побочными эффектами.
LL-37 обнаруживают в эпидермисе больных бородавками и остроконечными кондиломами, что подтверждает их роль в защите от папилломавирусных инфекций. Содержание β-дефензинов-1 и -2 значительно выше у больных с акне и распространенным фолликулитом, чем у здоровых лиц.
При язвенных поражениях кожи факторы роста, участвующие в заживлении раны, стимулируют синтез кателицидинов. Концентрация LL-37 зависит от длительности существования язвы, при острых язвах уровень LL-37 повышен, а при хронических язвах — низкий. Показано, что кателицидины могут стимулировать и ангиогенез, способствуя таким образом реваскуляризации поврежденной ткани.
При острых поражениях тканей кожи, например, при ожогах, антимикробные пептиды не успевают синтезироваться и содержание β-дефензинов не повышено, что объясняет частое инфицирование ожоговых поражений и развитие септических осложнений.
Таким образом, антимикробные пептиды являются звеном иммунитета, которое играет роль в патогенезе воспалительных заболеваний и обеспечивает защиту кожи. Дальнейшее изучение антимикробных пептидов может пролить свет на патогенез многих воспалительных заболеваний кожи и позволит разработать новые подходы терапии, основанные на молекулярных механизмах.
Козловская В. В. Гомельский государственный медицинский университет.
Журнал «Медицинская панорама» № 1, январь 2009.