Неуклонный рост заболеваемости сахарным диабетом, особенно 2-го типа (СД 2), обусловливает интерес клиницистов к рациональной оценке возможностей снижения риска развития поздних осложнений, среди которых значимое место занимает диабетическая нефропатия (ДН).
Актуальность обеспечения нефропротекции обусловлена:
- Высоким уровнем смертности (каждый второй больной с диабетом типа 1 и каждый четвертый пациент с СД 2 умирает от диабетической нефропатии), в результате около 20% лиц с СД умирают от почечных заболеваний.
- Частотой выявления диабетической нефропатии (каждый четвертый пациент с СД 2 уже при манифестации имеет признаки диабетической нефропатии).
С точки зрения нефрологов и кардиологов: - среди пациентов с хронической болезнью почек (ХБП) более 45% составляют лица с СД (по сравнению с 18% в 1980 г.);
- 50% пациентов с финальной стадией заболевания почек на гемодиализе имеют диабет;
- протеинурия — важный предиктор сердечно-сосудистых заболеваний, конечной стадии болезни почек и смерти;
- при наличии микроальбуминурии (МИКА) риск развития сердечно-сосудистых заболеваний увеличивается вдвое по сравнению с нормоальбуминурией;
- с повышением уровня альбуминурии и снижением скорости клубочковой фильтрации риск развития сердечно-сосудистых заболеваний прогрессивно возрастает;
- анемия, связанная с патологией почек, может обнаруживаться при снижении почечной функции, когда скорость клубочковой фильтрации (СКФ) составляет 30-60 мл/мин (рис. 1);
- большинство лиц с ХБП 3-й степени умирают от сердечно-сосудистых заболеваний, особенно при СД. Стадии развития диабетической нефропатии и хронической болезни почек представлены в табл. 1.
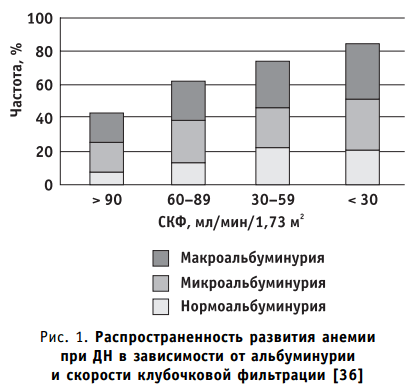
Таблица 1.
Стадии развития диабетической нефропатии и хронической болезни почек
| Диабетическая нефропатия | ||
| Стадия | Характеристика | Время появления от начала диабета, лет |
| I. Гиперфункция почек | Гиперфильтрация Гиперперфузия Гипертрофия почек Нормоальбуминурия (Дебют сахарного диабета | |
| II. Начальные структурные изменения почек | Утолщение базальной мембраны клубочков Экспансия мезангия Гиперфильтрация Нормоальбуминурия (> 2-5 | |
| III. Начинающаяся диабетическая нефропатия | Микроальбуминурия (от 30 до 300 мг/сут) Нормальная или умеренно повышенная СКФ | >5 |
| IV. Выраженная диабетическая нефропатия | Протеинурия Артериальная гипертония Снижение СКФ Склероз 50-75% клубочков | >10-15 |
| V. Уремия | Снижение СКФ < 10 мл/мин Тотальный гломерулосклероз | >10-15 |
| Хроническая болезнь почек | ||
| Стадия | Характеристика | Тактика ведения |
| I | Повреждение почек с нормальной или повышенной СКФ (> 90 мл/мин/1,73 м2) | Диагностика и лечение Коррекция сопутствующей патологии Торможение прогрессирования почечной патологии Снижение выраженности факторов риска сердечно-сосудистых заболеваний Прогноз прогрессирования |
| II | Повреждение почек с начальным снижением СКФ (60-89 мл/мин/1,73 м2) | |
| III | Умеренная степень снижения СКФ (30-59 мл/мин/1,73 м2) | Торможение прогрессирования Выявление и лечение осложнений |
| IV | Выраженная степень снижения СКФ (15-29 мл/мин/1,73 м2) | Торможение прогрессирования Выявление и лечение осложнений Подготовка к заместительной почечной терапии |
| V | Почечная недостаточность (2 или диализ) | Заместительная почечная терапия (гемодиализ, перитонеальный диализ, трансплантация почки) |
Примечание: СКФ — скорость клубочковой фильтрации, рассчитанная по формулам Кокрофта-Голта или MDRD.
Важнейшим диагностическим критерием для верификации диабетической нефропатии является скорость клубочковой фильтрации, которая рассчитывается по формуле Кокрофта-Голта:

В патогенезе диабетической нефропатии принимают участие различные факторы:
1. Метаболические:
- неферментативное гликозилирование белков с образованием конечных продуктов гликозилирования и утолщением базальной мембраны;
- нарушение синтеза гликозамингликанов с образованием гепарансульфата;
- гиперлипидемия, обусловливающая токсическое влияние свободных радикалов;
- гипергликемия и глюкозотоксичность приводят к изменению ионного заряда мембран клубочков и дилатации приносящей артериолы клубочка.
2. Гемодинамические факторы:
- системная артериальная гипертензия;
- внутриклубочковая гипертензия, развивающаяся вследствие дилатации приносящей и констрикции выносящей артериол с увеличением объема первичной мочи (осмотический диурез) и развитием гиперфильтрации.
3. Генетические факторы:
- полиморфизм генов, регулирующих синтез ангиотензинпревращающего фермента и артериальное давление, — гены ренина и ангиотензиногена, ангиотензинпревращающего фермента, рецепторов ангиотензиногена (тип 1), Na/Li противотранспорта, Na/H обмена;
- полиморфизм генов, обусловливающих пролиферацию мезангиума — перлекан-ген и ген, кодирующий синтез коллагена, ген N-деацетилазы, ген 1Е-1, ген IL-1p, ген рецепторов IL-1).
4. Иммунные факторы:
- повышение в крови уровней иммунных комплексов и продуктов деградации комплемента;
- наличие антител к различным структурам и др.
В результате взаимодействия метаболических и гемодинамических нарушений создаются условия для внутриклубочковой гипертензии и последовательного развития гиперфильтрации с нарушением проницаемости гломерулярного фильтра и, наконец, формируется гломерулосклероз. Прогрессирование почечной недостаточности сопровождается развитием интерстициального фиброза. Морфологические структурно-функциональные изменения в биоптате почек при СД 1 и 2 одинаково характеризуются увеличенным объемом интерстиция, степень которого обратно пропорциональна клиренсу креатинина крови, что подтверждает роль поражения тубулоинтерстиция в прогрессировании потери функции почек и развитии анемии при СД.
Среди факторов, определяющих риски развития внутриклубочковой гипертензии, имеют значение метаболические, способствующие дилатации приносящей артериолы (глюкоза, оксид азота, гормон роста, глюкагон, простациклин и др.) и гемодинамические факторы, вызывающие констрикцию выносящей артериолы (ангиотензин II, катехоламины, тромбоксан А2, эндотелин), что обусловливает выбор нефропротективных средств. Важнейшим фактором, вызывающим вазоконстрикцию выносящей артериолы, является ангиотензин II, основные функции которого представлены в табл. 2.
Таблица 2.
Основные функции локального почечного ангиотензина II
| Функция | Эффект |
| Суживает выносящую артериолу клубочка | Внутриклубочковая гипертензия |
| Увеличивает проницаемость клубочкового фильтра | Повышается протеинурия Понижается селективность протеинурии |
| Повышает пролиферацию клубочковых и канальцевых клеток, синтез коллагена | Гломерулосклероз Тубулоинтерстициальный фиброз |
| Повышает перекисное окисление | Интерстициальный фиброз |
| Иммуномодуляция (повышается МСР-1, повышается RANTES) | Пролиферация фибробластов Инфильтрация Т-лимфоцитами |
Патогенетические механизмы развития диабетической нефропатии позволяют выделить регулируемые и нерегулируемые факторы. К регулируемым факторам относятся метаболические и гемодинамические, так как регулирование иммунных факторов до настоящего времени остается спорным, а генетических — невозможным. Именно поэтому стратегия нефропротекции при СД основана на нормализации метаболических процессов (в первую очередь гипергликемии и гиперлипидемии), а также почечной гемодинамики.
С другой стороны, несомненно, что артериальная гипертензия способствует более быстрому прогрессированию поражения органов-мишеней и ускорению формирования диабетической нефропатии, так как обусловливает гемодинамические нарушения в клубочках, вызывает ремоделирование крупных и периферических артерий, приводит к нарушениям микроциркуляции и ауторегуляции почечного кровотока. Кроме того, сердечно-сосудистые заболевания и СД имеют общий механизм развития, который реализуется гиперактивацией ренин-ангиотензиновой системы, что подтверждается повышением активности ангиотензинпревращающего фермента в плазме у больных СД разной степени тяжести по сравнению со здоровыми.
В настоящее время наряду с коррекцией рациона питания и ограничением потребления белка неоспоримо доказано наличие нефропротективного эффекта у блокаторов ренин-ангиотензиновой системы (РАС) — ингибиторов ангиотензинпревращающего фермента (иАПФ) или блокаторов рецепторов ангиотензина II, основанного на нескольких механизмах. Главный механизм системного действия иАПФ основан на блокаде вазоконстриктора ангиотензина II, избирательном влиянии на тонус эфферентной артериолы клубочка и снижении внутриклубочковой гипертензии. В результате восстанавливается проницаемость базальных мембран капилляров, что сопровождается снижением потери гепарансульфата клубочками и исчезновением или снижением микроальбуминурии или протеинурии, что позволяет рекомендовать иАПФ в случаях диабетической нефропатии, диагностированной по повышенной скорости клубочковой фильтрации или микроальбуминурии еще до развития артериальной гипертензии. У пациентов с артериальной гипертензией нефропротективное действие иАПФ усиливается благодаря системному гипотензивному эффекту. Кроме того, имеются данные, свидетельствующие о том, что иАПФ могут непосредственно снижать гломерулярную проницаемость для белка, уменьшая размер селективных пор мембраны, а также предотвращать потерю клубочками гепарансульфата, пролиферацию мезангиума и гипертрофию клубочков, а также в связи с позитивным влиянием на состояние углеводного обмена.
Таким образом, для обеспечения нефропротективного эффекта при СД необходимо одновременно обеспечить адекватную длительную компенсацию углеводного обмена, поддержание нормальных показателей артериального давления (менее 130/ 80 мм рт. ст.) и снизить внутриклубочковую гипертензию. Наличие большого количества лекарственных средств для коррекции отдельных патогенетических компонентов диабетической нефропатии ставит перед врачом сложнейшую задачу: выбор комплекса препаратов, обеспечивающих улучшение функционального состояния почек при СД на фоне оптимизации гликемии.
Согласно консенсусу между Европейской ассоциацией по изучению диабета и Американской диабетологической ассоциацией, в качестве доказательно-эффективной по отдаленным результатам гипогликемизирующей терапии СД 2-го типа рекомендуется инициация лечения метформином с последующим использованием либо производных сульфонилмочевины, либо инсулинотерапии. В то же время, отмечены преимущества отдельных производных сульфонилмочевины — гликлазида и глимепирида, что основано на более низкой частоте регистрации гипогликемических реакций при их использовании.
Есть ли дополнительные преимущества, реализующиеся нефропротективным эффектом у препаратов сульфонилмочевины? В настоящее время получены убедительные доказательства наличия значимого нефропротективного эффекта у гликлазида (Диабетона MR). С другой стороны, все ли иАПФ обеспечивают выраженный нефропротективный эффект? Известно, что при СД оптимальным выбором считается использование комбинированной гипотензивной терапии. Так какая комбинация иАПФ обеспечит нефропротекцию?
Доказательства значимого нефропротективного эффекта получены для комбинированного гипотензивного препарата периндоприла и индапамида (Нолипрел форте А). В 2008 г. успешно завершено масштабное исследование ADVANCE (Action in Diabetes and Vascular Disease: Preterax and Diamicron MR Controlled Evaluation). Крупнейшее проспективное многоцентровое двухфакториальное исследование ADVANCE оценивало наблюдение за 11140 пациентами высокого риска по сердечно-сосудистой патологии из 215 научных центров 20 стран в течение 5 лет, рандомизированных на 4 группы:
- плацебо + стандартная гипогликемизирующая терапия;
- плацебо + гликлазид MR 30-120 мг;
- стандартная гипогликемизирующая терапия + фиксированная комбинация периндоприл + индапамид;
- фиксированная комбинация периндоприл + индапамид + гликлазид MR.
Для оценки нефропротективного эффекта были использованы следующие «конечные точки»:
- впервые выявленная микроальбуминурия (UACR* 30-300 μ г/мг);
- впервые диагностированная диабетическая нефропатия (UACR > 300 μ г/мг);
- удвоение сывороточного креатинина более 200 μ моль/л (2,3 мг/дл);
- необходимость почечно-заместительной терапии или смерть, обусловленная патологией почек.
UACR — коэффициент соотношения экскреции альбумина с мочой и уровня креатинина в моче, характеризующих основные показатели диабетической нефропатии.
Относительный риск развития микро- и макрососудистых осложнений в целом при анализе гипотензивной ветви снизился на 9% (р = 0,41). Однако при изолированной оценке влияния Нолипрела форте А (периндоприл 5 мг + индапамид 1,25 мг) на риск развития нефропатии было отмечено его снижение на 21% (р < 0,001). При этом риск появления МИКА снизился на 21%, а появление макроальбуминурии — на 31% (р < 0,001). При этом доказано, что Нолипрел форте А не только предотвращает возникновение или прогрессирование нефропатии, но также вызывает регресс почечных осложнений у каждого шестого пациента с СД: регресс микроальбуминурии на 16% (р = 0,002) и восстановление до нормоальбуминурии на 15% (р < 0,007). Впервые такая мощная нефропротекция наблюдалась наряду с предотвращением кардиоваскулярных катастроф.
В то же время риск прогрессии альбуминурии в группе плацебо повысился, по оценке общего коэффициента событий на пациента, на 22% (р < 0,0001).
Полученные данные отражают результат синергизма эффектов периндоприла и индапамида. Поскольку эффективность иАПФ не вызывает сомнений, остановимся на преимуществах тиазидоподобных диуретиков, в частности, индапамида ретард. Препараты этой группы характеризуются:
- метаболической нейтральностью в отношении липидного и углеводного обмена;
- более выраженным гипотензивным эффектом по сравнению с тиазидными диуретиками с преимущественным влиянием на систолическое артериальное давление (в том числе при изолированной систолической артериальной гипертензии);
- значимым уменьшением массы левого желудочка за счет уменьшения толщины межжелудочковой перегородки и задней стенки) при незначительном уменьшении диаметра левого желудочка;
- отсутствием выраженного диуретического эффекта и влияния на экскрецию калия;
- снижением риска инсульта — доказанного следствия гипокалиемии.
В исследовании NESTOR (Natrilix SR versus Enalapril Study in hypertensive Type 2 diabetics with micrOalbuminuRia) лечение тиазидоподобным диуретиком индапамидом ретард (Арифон ретард) в течение одного года достоверно (на 35%) уменьшало микроальбуминурию у лиц с СД 2. При этом выраженность снижения была такой же, как при лечении эналаприлом, а индекс альбумин/креатинин в моче был достоверно ниже в группе индапамида ретард (межгрупповые различия CI 95% составили 0,95 (0,68; 1,34) при p = 0,0236).
Таким образом, анализ результатов гипотензивной ветви исследования ADVANCE свидетельствует о том, что своевременное (с начальной стадии диабетической нефропатии) назначение фиксированной комбинации периндоприл + индапамид (Нолипрел форте А) с обеспечением поддержания рекомендованного уровня артериального давления (130/80 мм рт. ст.):
- снижает риск микроальбуминурии на 21%;
- снижает макроальбуминурию (протеинурию) на 31%;
- снижает риск заболеваний почек на 21%.
Относительный риск развития микро- и макрососудистых осложнений в целом при анализе гипогликемической ветви при использовании Диабетона MR снизился на 10% (р = 0,013). Однако при изолированной оценке влияния Диабетона MR на риск развития микрососудистых осложнений было отмечено его снижение на 14% (р < 0,014). При этом риск появления макроальбуминурии снизился на 30% (р < 0,001), а новых случаев или ухудшения диабетической нефропатии — на 21% (р < 0,006).
При анализе суммарного влияния интенсивного контроля гликемии Диабетоном MR и артериальной гипертензии Нолипрелом форте А выявлено снижение относительного риска развития ухудшения течения диабетической нефропатии или новых случаев диабетической нефропатии на 33% (р = 0,005).
Риск развития терминальной стадии хронической болезни почек или удвоения уровня креатинина более 200 ммоль/л в зависимости от исходного уровня альбуминурии по результатам исследования ADVANCE свидетельствует о прогрессивном ухудшении прогноза при нарастании уровня альбуминурии. Таким образом, снижение уровня альбуминурии при использовании Диабетона MR и Нолипрела форте А является важным фактором, обеспечивающим риск развития конечной (терминальной) стадии хронической болезни почек как исхода диабетической нефропатии. При этом отмечается синергизм влияния иАПФ периндоприла в комбинации с индапамидом и производного сульфонилмочевины гликлазида.
Поскольку большинство пациентов с СД составляют пациенты с СД 2, приведенные результаты аргументируют целесообразность широкого использования для гипогликемизирующей терапии гликлазида (Диабетон MR), который обеспечивает не только низкий риск гипогликемических реакций и снижение риска сердечно-сосудистой патологии при достижении целевых показателей углеводного обмена, но и мощную нефропротекцию. С другой стороны, четырехфакториальный дизайн приведенного исследования ADVANCE позволяет оценить нефропротективный эффект комбинированного препарата Нолипрел форте А. Кроме того, полученные результаты подтверждают гипотезу целесообразности мультифакториального терапевтического воздействия при лечении СД 2.
Мохорт Т. В., Холодова Е. А.
Белорусский государственный медицинский университет.
Журнал «Медицинская панорама» № 9, октябрь 2009.
